Collagène Peptan – Peau, ongle, cheveux et articulation
€52.90 Taxe inclue
- Cible : élasticité de la peau, tendinites et douleurs articulaires
- Contient tous les acides aminés nécessaires à la régénération des tissus articulaires
- Les peptides de collagène les plus étudiés : efficacité prouvée par de nombreuses études
- Peptan® B 2000 Daltons : le peptide de collagène de type 1 de référence – 100% pur
- Goût neutre – Posologie : 1 scoop soit 10g (4 mois d’utilisation) à 20g/jour
- L’un des rares et indispensable à consommer toute l’année surtout pour les plus âgés
Rupture de stock
- Utilisation
- Composition
- Précaution
- Références scientifiques
- Certificats
- Description
DOSAGE & PRÉPARATION
Prendre 10g (80% d’une dosette de 30ml) à 20g par jour. Cuillère doseuse incluse.
A PRENDRE DE PRÉFERENCE
- Le matin ou le midi ou le soir, pendant le repas
- Après l’entraînement
CONSEILS D’UTILISATION
10g à diluer dans :
- un verre d’eau avec un jus de citron
- du lait végétal.
- un jus de fruit ou de légume
- un smoothie
- un gaspacho
- votre shaker d’isolat de whey
- Directement en bouche en petite quantité
COMPOSITION
Collagène hydrolysé (peptides de collagène) d’origine bovine
INDICATIONS
Complément alimentaire à base d’hydrolysat de collagène.
INFORMATIONS NUTRITIONNELLES
| Informations nutritionnelles | Quantité par dose journalière (1 dosette) |
|---|---|
| Collagène | 10 g |
| Dont protéines | 9 g |
AVERTISSEMENT
Les compléments alimentaires doivent être utilisés dans le cadre d’un mode de vie sain et ne pas être utilisés comme substituts d’un régime alimentaire varié et équilibré. Ne pas dépasser la dose journalière recommandée. Tenir hors de la portée des jeunes enfants
| Acides aminés | 10G | 100G |
|---|---|---|
| Glycine | 1850 mg | 18500 mg |
| Proline | 1040 mg | 10400 mg |
| Hydroxyproline | 1030 mg | 10300 mg |
| A. Glutamique | 1120 mg | 11200 mg |
| Arginine | 760 mg | 7600 mg |
| Alanine | 730 mg | 7300 mg |
| A. Aspartique | 590 mg | 5900 mg |
| Lysine | 310 mg | 3100 mg |
| Sérine | 310 mg | 3100 mg |
| Leucine | 260 mg | 2600 mg |
| Valine | 220 mg | 2200 mg |
| Phénylalanine | 190 mg | 1900 mg |
| Thréonine | 170 mg | 1700 mg |
| Isoleucine | 140 mg | 1400 mg |
| Hydroxylysine | 110 mg | 1100 mg |
| Histidine | 70 mg | 700 mg |
| Méthionine | 50 mg | 500 mg |
| Tyrosine | 50 mg | 500 mg |
| TOTAL | 9 g | 90 g |
AVERTISSEMENT
Les compléments alimentaires doivent être utilisés dans le cadre d’un mode de vie sain et ne pas être utilisés comme substituts d’un régime alimentaire varié et équilibré.
Ne pas dépasser la dose journalière recommandée.
Tenir hors de la portée des jeunes enfants.
Vous pouvez vous rapprocher de votre votre médecin traitant afin d’être conseillé sur les compléments alimentaires.
1. QU’EST-CE QUE LE COLLAGÈNE ?
Protéine la plus abondante du corps humain, le collagène joue un rôle dans la structure des tissus conjonctifs : cartilages, tendons, ligaments, cartilage, os, peau… Cette protéine fibrillaire agit comme un maillage et assure la cohésion, l’élasticité et la régénération des tissus (1). De nombreux types de collagène existent mais 3 catégories de collagène prédominent :
- Le collagène de type I, le plus abondant chez les vertébrés (90%), constituant la peau, les tendons et le tissu osseux.
- Le collagène de type II constituant les cartilages.
- Le collagène de type III constituant les muscles et dans les parois des vaisseaux sanguins.
Connue pour ses propriétés antirides, cette protéine présente d’autres usages intéressants.
2. POURQUOI SE SUPPLÉMENTER ?
A partir de 25 ans, la qualité et la quantité de collagène produites par l’organisme s’altère lentement. Après 40 ans, la synthèse de collagène diminue de 1 % par an, et autour de 80 ans, la composition corporelle en collagène a pu réduire de 75% par rapport à un adulte jeune (2,3). Cette dégradation physiologique, est intimement liée à l’âge, à des facteurs génétiques ou encore à des facteurs environnementaux (rayons solaires, pollution, radicaux libres induits par une mauvaise pratique sportive…, malbouffe, tabac, alcool, maladie).
Lors de la complémentation par du collagène hydrolysé, il ne s’agit pas de prendre des « bouts de collagène » qui vont remplacer le collagène défaillant mais d’apporter des molécules de collagène hydrolysé qui stimulent des voies de signalisation cellulaire responsables de la production naturelle du collagène par notre propre organisme.
3. COMMENT EST SYNTHÉTISÉ LE COLLAGÈNE ?
Le collagène est fabriqué à partir du précollagène dans les cellules cartilagineuses (chondrocytes), les cellules osseuses (ostéoblastes) ou encore dans les fibroblastes de la peau. Ce précollagène est ensuite coupé, allongé, associé en chaine et excrété.
Le collagène est une protéine constituée de trois chaines d’un millier d’acides aminés chacune qui s’enroulent pour former une triple hélice qui s’organise en fibre résistantes. On pourrait le comparer à un gros « scoubidou ». Les acides aminés qui le constituent sont principalement la glycine, la proline, l’hydroxyproline, la lysine et l’hydroxylysine.
L’assemblage des protéines entre elles est dépendante de la présence d’hydroxyproline. En absence de cet acide aminé, la triple hélice est instable. L’hydroxylation (ajout d’un groupe hydroxyle -OH) de la proline dépend elle-même de la présence de vitamine C. C’est pourquoi, une carence en vitamine C conduit à une mauvaise synthèse de collagène entrainant une fragilisation des vaisseaux sanguins, des tendons, de la peau qui se traduit par une maladie qui sévissait lors des grandes expéditions maritimes menées entre le XVe et le XVIIIe siècle, le scorbut.
4. QU’EST-CE QUE LE COLLAGÈNE HYDROLYSÉ OU LES PEPTIDES DE COLLAGÈNE ?
Le collagène hydrolysé est un mélange de molécules de collagènes découpées (peptides).
Utilisé depuis longtemps, notamment dans l’industrie agroalimentaire, le collagène natif est difficilement absorbé par la barrière intestinale. Pour pallier ce défaut, on effectue une « découpe » des molécules de collagène appelée hydrolyse. L’hydrolyse permet d’obtenir des petits segments protidiques de faible poids moléculaire appelés « peptides » assimilable(s) au niveau du tractus gastro-intestinal et disponible(s) pour notre organisme.
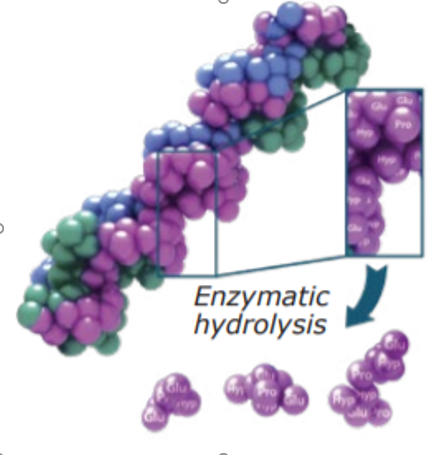
Les propriétés du collagène hydrolysé dépendent de son absorption, elle-même régit par plusieurs facteurs :
- L’origine du tissu source : Le collagène de type I peut être extrait de différentes sources animales (bovine, porcine, piscicole), mais la source principale d’extraction est bovine en raison de disponibilité et de sa biocompatibilité.
- Le poids moléculaire. Différentes études suggèrent que le collagène hydrolysé de faible poids moléculaire a une meilleure biodisponibilité que les autres grâce à sa miscibilité le rendant mieux assimilable au niveau intestinal (4). Par exemple, les collagènes hydrolysés ayant un poids moléculaire moyen de 2000 Da augmentent plus efficacement l’activité ostéoblastique que ceux composés de peptides ayant un poids moyen de 6000 Da (5).
Notre système digestif est capable de fragmenter à son tour le collagène hydrolysé en petits peptides d’acides aminés. Ces di- ou tri-peptides composés en grande partie de glycine, proline et hydroxyproline (6) passent la muqueuse intestinale à l’aide d’un transporteur vers le sang circulant où il peuvent être mesurés dans l’heure qui suit leur ingestion (7). Ces acides aminés circulant auront alors une action sur les cellules des différents tissus contenant du collagène (tendons, os, cartilage, peau….). Il a était montré chez les souris que les composants du collagène hydrolysé, tracés par radioactivité, s’accumulaient au niveau du cartilage (8), de la moelle osseuse ou encore de la peau (9) y exerçant directement leur effet biologique.
5. COMMENT EST-OBTENU LE COLLAGÈNE HYDROLYSÉ ?
Les collagènes hydrolysés sont obtenus à partir de tissus animaux d’origine bovine, porcine ou encore piscicole. Le processus de fabrication se scinde en trois étapes essentielles :
- Le prétraitement de la matière première et l’élimination des impuretés.
- L’extraction chimique (hydrolyse basique ou acide) ou par procédé enzymatique. Le traitement enzymatique, plus novateur, est plus efficace (6) donnant un produit fini de meilleure qualité. Le résultat produit permet d’obtenir des peptides de collagènes de poids moléculaire compris entre 2000 et 6000 Dalton.
- Le raffinement du produit (filtration, clarification, évaporation, stérilisation, séchage, broyage et tamisage) afin d’obtenir un produit fini de qualité.
Le collagène est un produit agroalimentaire courant sans effet délétère à long terme et reconnu comme GRAS (Generally recognised as Safe) par le Food and Drug Administration (FDA). NUTRIPURE a choisi un collagène bovin de faible poids moléculaire (2000 Da), le PEPTAN®, extrait par Rousselot garantissant au consommateur :

6. LE RÔLE DU COLLAGÈNE SUR LE MUSCULO SQUELETTE
Le collagène joue un rôle essentiel au niveau de la structure osseuse, tendineuse et du cartilage : La santé de notre collagène vont donc jouer un rôle primordial pour le maintien d’une bonne mobilité articulaire, que l’on soit sportif ou une personne avançant dans l’âge.
A. MUSCLE – TENDON – ARTICULATION chez le sportif
Un récent consensus du comité international olympique a statué sur les compléments alimentaires des sportifs de haut niveau (10) et suppose qu’une supplémentation par collagène hydrolysé puisse être bénéfique pour les athlètes pour moduler la synthèse de collagène (7), réduire les douleurs tendineuses et les douleurs articulaires (11,12).
- TENDON :
La glycine, le composant le plus abondant du collagène hydrolysé, modulerait l’organisation de la matrice collagène, le remodelage des cellules tendineuses et la disponibilité des précurseurs du collagène (13). D’un point de vue clinique, elle modifierait les propriétés et l’inflammation tendineuse (14).
L’apport de collagène hydrolysé pourrait changeait la structure des fibres de collagènes ainsi que la composition en protéoglycanes (15).
La supplémentation orale par collagène hydrolysé pourrait accélérer les bénéfices de la kinésithérapie de renforcement musculaire chez des patients souffrant de tendinopathie d’Achille (16), comme cela a été suggéré dans une étude en 2019.
Une étude relate également les effets du collagène hydrolysé dans l’instabilité articulaire chronique d’origine ligamentaire qui peut faire suite à une entorse de cheville. Une étude portant sur 50 athlètes randomisés en double aveugle étudiait l’effet d’une supplémentation de 5g/ jour de collagène hydrolysé pendant 6 mois pour améliorer l’instabilité articulaire chronique de cheville (17). Au terme des 6 mois de suivi, la perception d’instabilité avait réduit dans le groupe recevant du collagène hydrolysé ainsi que le risque de survenue d’une nouvelle blessure tendineuse.
L’effet bénéfique des peptides de collagène chez les patients souffrant de tendinopathie (18) semble prometteur.
- DOULEURS :
Les peptides de collagènes pourraient avoir un effet positif sur les articulations du sportif indemnes d’arthrose mais souffrant d’une surutilisation. Un essai randomisé en double aveugle mené chez 147 sportifs pendant 24 semaines analysait l’effet du collagène hydrolysé sur la douleur articulaire évaluée par échelle visuelle analogique. Le groupe recevant une complémentation journalière de 10g/ jour de peptides de collagène notait une amélioration des douleurs et de l’inconfort articulaire par rapport au groupe placebo. Toutefois, cette étude comportait des biais lié à un nombre important de perdu de vue et une étude statistique de faible qualité (19).
- MUSCLE :
Le collagène est riche en glycine et en arginine, des acides aminés essentiels à la synthèse de la créatine (20). Par conséquent, le collagène hydrolysé pourrait prendre part dans la construction de la masse musculaire.
Afin de trouver une explication à l’effet du collagène hydrolysé dans l’anabolisme musculaire, une étude (21) a été menée en 2015 chez des hommes de plus de 65 ans présentant une sarcopénie (perte de masse musculaire) en lien avec leur grand âge. Pendant 3 mois, 53 patients ont réalisé des exercices de renforcement musculaire adjoint d’une supplémentation protéique associée ou non à un apport en collagène hydrolysé à la dose de 15g/ jour. Au terme des 12 semaines, les hommes qui prenaient du collagène, en plus de l’entraînement physique et de la prise de protéine, ont vu leur masse musculaire augmenter de façon plus importante. On pourra toutefois reprocher à cette étude, la prise concomitante de protéine pouvant induire un facteur de confusion statistique ainsi que le faible effectif de patient inclus.
D’autres travaux ont été entrepris pour étudier l’effet du collagène hydrolysé sur la récupération et sur la prise de masse musculaire chez le sportif.
Une étude publiée en 2019 (22) étudiait l’impact du collagène hydrolysé sur la récupération à l’effort. Chez 24 patients supplémentés par 20g/ jour de collagène hydrolysé (PEPTAN) 7 jours avant et 2 jours après un effort important (sauts), on observait une diminution des douleurs musculaires et une amélioration de la récupération.
La supplémentation en collagène hydrolysé pendant un exercice de résistance influencerait la composition protidique musculaire et pourrait augmenter la masse maigre ainsi que la force musculaire (23).
L’effet sur la masse musculaire du collagène hydrolysé semble intéressant, notamment chez le sportif et le sujet âgé.
B. ARTHROSE
Dans les années 1980, plusieurs essais ont été menés pour étudier l’effet du collagène dans le cadre du traitement de l’arthrose.
Le collagène hydrolysé diminuerait les douleurs articulaires et la mobilité chez des patients souffrant d’arthrose. Le mécanisme d’action sur la matrice cartilagineuse n’est pas encore clairement établi mais de nombreuses hypothèses existent et s’étoffent au fur et à mesure que les découvertes scientifiques avancent :
- Effet stimulant sur les chondrocytes (24).
- Effet sur les enzymes de dégradation du cartilage (les métalloprotéases) et sur la régénération du collagène (25).
- Effet stimulant et changement de la composition des protéoglycanes (26).
En 2000, une première étude menée chez l’homme mentionne l’effet bénéfique du collagène hydrolysé chez des patients souffrant d’arthrose sévère (27).
Récemment, un essai clinique contrôlé randomisé multicentrique (28) de qualité a évoqué l’efficacité du collagène hydrolysé sur les articulations. Pendant 6 mois, 250 sujets souffrant d’arthrose du genou recevaient une supplémentation journalière de 10g de peptides de collagène. Au terme de l’étude, on observait une diminution des douleurs et une amélioration de la fonctionnalité articulaire dans le groupe supplémenté en collagène hydrolysé. L’effet était d’autant plus marqué que l’altération cartilagineuse était importante et l’apport alimentaire protéique faible.
Le collagène fait partie de l’arsenal moléculaire qui pourrait être proposer dans la prise en charge de l’arthrose (29,30).
C. DENSITE MINERALE OSSEUSE
Devant ses effets sur le tissu osseux, le collagène hydrolysé a été étudié en vue de réduire la progression de l’ostéoporose.
L’ostéoporose correspond à une perte de la masse osseuse caractérisée par une diminution de la densité minérale osseuse (DMO) associée à une altération de la microarchitecture de l’os qui entraînent une augmentation du risque de fracture. La ménopause est, chez la femme, le principal facteur favorisant la déminéralisation osseuse.
Une étude translationnelle publiée en 2019 démontrait que le collagène hydrolysé à un impact direct sur le comportement des cellules osseuses aussi bien chez l’homme que dans un modèle murin. De plus, une réduction de la déminéralisation osseuse était observait chez les souris supplémentées par collagène hydrolysé (5).
Si plusieurs études évoquent l’influence du collagène sur le métabolisme osseux, le mécanisme d’action sur les cellules osseuses reste à préciser :
- Effet sur la différenciation des lignées cellulaires ostéoblastiques (31) par le biais de signaux moléculaires : voie des MAP kinases (32), cytokines, facteurs de croissance… qui modulent l’expression de gènes de synthèse du collagène
- Action sur le dialogue entre ostéoblaste et ostéoclaste (5). In vivo et in vitro, la présence de collagène hydrolysé stimulerait l’activité ostéoblastique et donc la formation osseuse, tout en inhibant l’activité de résorption des ostéoclastes. En favorisant la phase de formation osseuse, le collagène hydrolysé ingéré inhiberait la perte osseuse et augmenterait la résistance à la cassure des os.
En 2014, un essai clinique (33) investiguait les effets d’une supplémentation en collagène hydrolysé associé à du calcium et de la vitamine D3 chez 39 femmes ménopausées. La perte de masse osseuse à 12 mois était moins marquée dans le groupe recevant des peptides de collagène, suggérant leur efficacité en association à une supplémentation vitamino-calcique. Toutefois, le faible nombre de sujet étudié dans cette étude rendait les résultats difficilement extrapolables à une population.
En 2018, Koning rapportait l’effet bénéfique du collagène hydrolysé sur la masse osseuse chez des patientes ménopausées. Cet essai clinique randomisé (34) étudiait la formation et la densité minérale osseuse chez 131 patientes ménopausées après 12 mois de supplémentation à 5g/ jour. Au terme des 12 mois, la densité minérale osseuse du rachis et de la tête fémorale des patientes recevant le collagène hydrolysé augmentait. De plus, les marqueurs biologiques du turn-over osseuse indiquait un remodelage en faveur de l’ostéoformation. Un des biais de cette étude était la prise concomitante non contrôlée de calcium et de vitamine D, pouvant agir comme un facteur de confusion. De bonne qualité statistique, cette étude incluait l’ensemble des patientes randomisées dans son analyse.
L’effet du collagène hydrolysé sur la matrice osseuse semble intéressant en particulier chez la femme ménopausée et mérite d’autres études afin d’établir des conseils à une population.
7. LE COLLAGÈNE ET LA BEAUTÉ
A. Peau
Les peptides de collagène sont des nutri-cosmétiques utilisé dans la santé de la peau. Dans les études précliniques, différents effets du collagène hydrolysé sur la peau ont été mis en évidence :
- Effet sur la production d’acide hyaluronique par les fibroblastes de la peau (35).
- Effet sur la synthèse protéique des molécules de collagène (36), la production de fibrilles de collagène denses et robustes (37) et la croissance des fibroblastes (38).
La consommation de collagène hydrolysé collagène permettrait d’améliorer l’élasticité de la peau selon une étude réalisée en 2014 (39) sur un groupe de femmes âgées de 35 à 55 ans ainsi que de réduire des ridules du pourtour des yeux après 8 semaines de complémentation (40).
Un essai pilote analysait l’hydratation de la peau chez 33 patientes après une supplémentation de 10g/ jour de collagène hydrolysé pendant 2 mois (41). Les peptides de collagène (PEPTAN®) amélioreraient l’hydratation de la peau de 16% au bout de 4 semaines et de 28% après 8 semaines.
Une étude randomisée monocentrique contrôlée (41) a été menée afin d’étudier les paramètres du vieillissement de la peau. Pendant 12 semaines, 106 patientes recevaient de façon journalière soit 10g de placebo (n = 52) soit 10g de peptides de collagène PEPTAN® (n = 54). Différents effets étaient observés dans le groupe supplémenté par PEPTAN® :
- Augmentation de la densité du collagène dans le derme
- Réduction de la fragmentation et de l’altération du collagène dans le derme
- Augmentation du contenu en collagène et en glycosaminoglycanes de la peau
- Le collagène hydrolysé présenterait un intérêt dans la pris en charge du vieillissement cutané.
Le collagène hydrolysé présenterait un intérêt dans la pris en charge du vieillissement cutané.
B. Cellulite
La cellulite se traduit par un amas graisseux généralement au niveau des cuisses ou des fesses donnant un aspect capitonné à la peau souvent appelé peau d’orange.
Une étude randomisée réalisée en 2015 (42) montrait une amélioration de la texture de la peau chez un groupe de femmes âgées de 24 à 50 ans de poids normal ou en surpoids supplémentées par 2.5g/ jour de peptides de collagène pendant 6 mois.
Si cette étude est bien évidemment insuffisante pour tirer des conclusions définitives, elle ouvre cependant la voie et la réflexion sur l’utilité d’un complément de collagène pour réduire les effets de la cellulite.
1. Ricard-Blum S. The collagen family. Cold Spring Harb Perspect Biol. 1 janv 2011;3(1):a004978.
2. Varani J, Dame MK, Rittie L, Fligiel SEG, Kang S, Fisher GJ, et al. Decreased Collagen Production in Chronologically Aged Skin: Roles of Age-Dependent Alteration in Fibroblast Function and Defective Mechanical Stimulation. Am J Pathol. 1 juin 2006;168(6):1861‑8.
3. Baumann L. Skin ageing and its treatment. J Pathol. 2007;211(2):241‑51.
4. Hong H, Fan H, Chalamaiah M, Wu J. Preparation of low-molecular-weight, collagen hydrolysates (peptides): Current progress, challenges, and future perspectives. Food Chem. 15 déc 2019;301:125222.
5. Wauquier F, Daneault A, Granel H, Prawitt J, Fabien Soulé V, Berger J, et al. Human Enriched Serum Following Hydrolysed Collagen Absorption Modulates Bone Cell Activity: from Bedside to Bench and Vice Versa. Nutrients [Internet]. 31 mai 2019 [cité 13 déc 2019];11(6). Disponible sur: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6627680/
6. Skov K, Oxfeldt M, Thøgersen R, Hansen M, Bertram HC. Enzymatic Hydrolysis of a Collagen Hydrolysate Enhances Postprandial Absorption Rate-A Randomized Controlled Trial. Nutrients. 13 mai 2019;11(5).
7. Shaw G, Lee-Barthel A, Ross ML, Wang B, Baar K. Vitamin C-enriched gelatin supplementation before intermittent activity augments collagen synthesis. Am J Clin Nutr. 2017;105(1):136‑43.
8. Oesser S, Adam M, Babel W, Seifert J. Oral administration of (14)C labeled gelatin hydrolysate leads to an accumulation of radioactivity in cartilage of mice (C57/BL). J Nutr. oct 1999;129(10):1891‑5.
9. Kawaguchi T, Nanbu PN, Kurokawa M. Distribution of prolylhydroxyproline and its metabolites after oral administration in rats. Biol Pharm Bull. 2012;35(3):422‑7.
10. Maughan RJ, Burke LM, Dvorak J, Larson-Meyer DE, Peeling P, Phillips SM, et al. IOC consensus statement: dietary supplements and the high-performance athlete. Br J Sports Med. avr 2018;52(7):439‑55.
11. Zdzieblik D, Oesser S, Gollhofer A, König D. Improvement of activity-related knee joint discomfort following supplementation of specific collagen peptides. Appl Physiol Nutr Metab Physiol Appl Nutr Metab. juin 2017;42(6):588‑95.
12. Clark KL, Sebastianelli W, Flechsenhar KR, Aukermann DF, Meza F, Millard RL, et al. 24-Week study on the use of collagen hydrolysate as a dietary supplement in athletes with activity-related joint pain. Curr Med Res Opin. mai 2008;24(5):1485‑96.
13. Vieira CP, Viola M, Carneiro GD, D’Angelo ML, Vicente CP, Passi A, et al. Glycine improves the remodeling process of tenocytes in vitro. Cell Biol Int. 2018;42(7):804‑14.
14. Vieira CP, De Oliveira LP, Da Ré Guerra F, Dos Santos De Almeida M, Marcondes MCCG, Pimentel ER. Glycine improves biochemical and biomechanical properties following inflammation of the achilles tendon. Anat Rec Hoboken NJ 2007. mars 2015;298(3):538‑45.
15. Minaguchi J, Koyama Y, Meguri N, Hosaka Y, Ueda H, Kusubata M, et al. Effects of ingestion of collagen peptide on collagen fibrils and glycosaminoglycans in Achilles tendon. J Nutr Sci Vitaminol (Tokyo). juin 2005;51(3):169‑74.
16. Praet SFE, Purdam CR, Welvaert M, Vlahovich N, Lovell G, Burke LM, et al. Oral Supplementation of Specific Collagen Peptides Combined with Calf-Strengthening Exercises Enhances Function and Reduces Pain in Achilles Tendinopathy Patients. Nutrients. 2 janv 2019;11(1).
17. Dressler P, Gehring D, Zdzieblik D, Oesser S, Gollhofer A, König D. Improvement of Functional Ankle Properties Following Supplementation with Specific Collagen Peptides in Athletes with Chronic Ankle Instability. J Sports Sci Med. juin 2018;17(2):298‑304.
18. Baar K. Stress Relaxation and Targeted Nutrition to Treat Patellar Tendinopathy. Int J Sport Nutr Exerc Metab. 01 2019;29(4):453–457.
19. Clark KL, Sebastianelli W, Flechsenhar KR, Aukermann DF, Meza F, Millard RL, et al. 24-Week study on the use of collagen hydrolysate as a dietary supplement in athletes with activity-related joint pain. Curr Med Res Opin. mai 2008;24(5):1485‑96.
20. Brosnan JT, Brosnan ME. Creatine: endogenous metabolite, dietary, and therapeutic supplement. Annu Rev Nutr. 2007;27:241‑61.
21. Zdzieblik D, Oesser S, Baumstark MW, Gollhofer A, König D. Collagen peptide supplementation in combination with resistance training improves body composition and increases muscle strength in elderly sarcopenic men: a randomised controlled trial. Br J Nutr. 28 oct 2015;114(8):1237‑45.
22. Clifford T, Ventress M, Allerton DM, Stansfield S, Tang JCY, Fraser WD, et al. The effects of collagen peptides on muscle damage, inflammation and bone turnover following exercise: a randomized, controlled trial. Amino Acids. avr 2019;51(4):691‑704.
23. Oertzen-Hagemann V, Kirmse M, Eggers B, Pfeiffer K, Marcus K, de Marées M, et al. Effects of 12 Weeks of Hypertrophy Resistance Exercise Training Combined with Collagen Peptide Supplementation on the Skeletal Muscle Proteome in Recreationally Active Men. Nutrients. 14 mai 2019;11(5).
24. Oesser S, Seifert J. Stimulation of type II collagen biosynthesis and secretion in bovine chondrocytes cultured with degraded collagen. Cell Tissue Res. mars 2003;311(3):393‑9.
25. Isaka S, Someya A, Nakamura S, Naito K, Nozawa M, Inoue N, et al. Evaluation of the effect of oral administration of collagen peptides on an experimental rat osteoarthritis model. Exp Ther Med. juin 2017;13(6):2699‑706.
26. McAlindon TE, Nuite M, Krishnan N, Ruthazer R, Price LL, Burstein D, et al. Change in knee osteoarthritis cartilage detected by delayed gadolinium enhanced magnetic resonance imaging following treatment with collagen hydrolysate: a pilot randomized controlled trial. Osteoarthritis Cartilage. avr 2011;19(4):399‑405.
27. Moskowitz RW. Role of collagen hydrolysate in bone and joint disease. Semin Arthritis Rheum. oct 2000;30(2):87‑99.
28. Benito-Ruiz P, Camacho-Zambrano MM, Carrillo-Arcentales JN, Mestanza-Peralta MA, Vallejo-Flores CA, Vargas-López SV, et al. A randomized controlled trial on the efficacy and safety of a food ingredient, collagen hydrolysate, for improving joint comfort. Int J Food Sci Nutr. 2009;60 Suppl 2:99‑113.
29. Henrotin Y, Lambert C, Couchourel D, Ripoll C, Chiotelli E. Nutraceuticals: do they represent a new era in the management of osteoarthritis? – a narrative review from the lessons taken with five products. Osteoarthritis Cartilage. janv 2011;19(1):1‑21.
30. Bello AE, Oesser S. Collagen hydrolysate for the treatment of osteoarthritis and other joint disorders: a review of the literature. Curr Med Res Opin. nov 2006;22(11):2221‑32.
31. Andrianarivo AG, Robinson JA, Mann KG, Tracy RP. Growth on type I collagen promotes expression of the osteoblastic phenotype in human osteosarcoma MG-63 cells. J Cell Physiol. nov 1992;153(2):256‑65.
32. Rodríguez-Carballo E, Gámez B, Ventura F. p38 MAPK Signaling in Osteoblast Differentiation. Front Cell Dev Biol [Internet]. 2016 [cité 9 déc 2019];4. Disponible sur: https://www.frontiersin.org/articles/10.3389/fcell.2016.00040/full
33. Elam ML, Johnson SA, Hooshmand S, Feresin RG, Payton ME, Gu J, et al. A Calcium-Collagen Chelate Dietary Supplement Attenuates Bone Loss in Postmenopausal Women with Osteopenia: A Randomized Controlled Trial. J Med Food. 14 oct 2014;18(3):324‑31.
34. König D, Oesser S, Scharla S, Zdzieblik D, Gollhofer A. Specific Collagen Peptides Improve Bone Mineral Density and Bone Markers in Postmenopausal Women-A Randomized Controlled Study. Nutrients. 16 janv 2018;10(1).
35. Ohara H, Ichikawa S, Matsumoto H, Akiyama M, Fujimoto N, Kobayashi T, et al. Collagen-derived dipeptide, proline-hydroxyproline, stimulates cell proliferation and hyaluronic acid synthesis in cultured human dermal fibroblasts. J Dermatol. avr 2010;37(4):330‑8.
36. Zague V, de Freitas V, da Costa Rosa M, de Castro GÁ, Jaeger RG, Machado-Santelli GM. Collagen hydrolysate intake increases skin collagen expression and suppresses matrix metalloproteinase 2 activity. J Med Food. juin 2011;14(6):618‑24.
37. Matsuda N, Koyama Y, Hosaka Y, Ueda H, Watanabe T, Araya T, et al. Effects of ingestion of collagen peptide on collagen fibrils and glycosaminoglycans in the dermis. J Nutr Sci Vitaminol (Tokyo). juin 2006;52(3):211‑5.
38. Shigemura Y, Iwai K, Morimatsu F, Iwamoto T, Mori T, Oda C, et al. Effect of Prolyl-hydroxyproline (Pro-Hyp), a food-derived collagen peptide in human blood, on growth of fibroblasts from mouse skin. J Agric Food Chem. 28 janv 2009;57(2):444‑9.
39. Proksch E, Segger D, Degwert J, Schunck M, Zague V, Oesser S. Oral supplementation of specific collagen peptides has beneficial effects on human skin physiology: a double-blind, placebo-controlled study. Skin Pharmacol Physiol. 2014;27(1):47‑55.
40. Proksch E, Schunck M, Zague V, Segger D, Degwert J, Oesser S. Oral intake of specific bioactive collagen peptides reduces skin wrinkles and increases dermal matrix synthesis. Skin Pharmacol Physiol. 2014;27(3):113‑9.
41. Asserin J, Lati E, Shioya T, Prawitt J. The effect of oral collagen peptide supplementation on skin moisture and the dermal collagen network: evidence from an ex vivo model and randomized, placebo-controlled clinical trials. J Cosmet Dermatol. 2015;14(4):291‑301.
42. Schunck M, Zague V, Oesser S, Proksch E. Dietary Supplementation with Specific Collagen Peptides Has a Body Mass Index-Dependent Beneficial Effect on Cellulite Morphology. J Med Food. déc 2015;18(12):1340‑8.
Disponible à la demande
Description
UN CONCENTRÉ DE PEPTIDES DE COLLAGÈNE POUR VOS TISSUS
Le collagène est la protéine qui fournit aux articulations, aux muscles, aux tendons et à la peau leur solidité et leur élasticité.
Sa synthèse décline naturellement avec l’âge.
Une complémentation en collagène compense sa rareté dans notre alimentation moderne.
- Le collagène est omniprésent dans notre organisme
- Sa synthèse diminue avec l’âge
- Le collagène est peu présent dans notre alimentation moderne













Évaluation
Il n'y a pas encore d'évaluation.